Что такое озон
1. Историческая справка
В 1785 г. голландский физик Ван Марум, проводя опыты с электричеством, обратил внимание на запах при образовании искр в электрической машине и на окислительные способности воздуха после пропускания через него электрических искр.
В 1840 г. немецкий ученый Шейнбейн, занимаясь гидролизом воды, пытался с помощью электрической дуги разложить её на кислород и водород. И тогда он обнаружил, что образовался новый, доселе неизвестный науке, газ со специфическим запахом. Имя «озон» было присвоено газу Шейнбейном из-за характерного запаха и происходит оно от греческого слова «озиен», что значит «пахнуть».
22 сентября 1896 г. изобретатель Никола Тесла запатентовал первый генератор озона.
В 1857 г. с помощью созданной Вернером фон Сименсом «совершенной трубки магнитной индукции» удалось построить первую техническую озоновую установку. В 1901 г. фирмой «Сименс» построена первая гидростанция с озонаторной установкой в Висбанде.
Исторически применение озона началось с установок по подготовке питьевой воды, когда в 1898 году в городе Сан Мор (Франция) прошли испытания первой опытно-промышленной установки. Уже в 1907 году был построен первый завод по озонированию воды в городе Бон Вуаяж (Франция), для нужд города Ниццы. В 1911 г. была пущена в эксплуатацию станция озонирования питьевой воды в Санкт-Петербурге (в настоящее время не действует). В 1916 г. действовало уже 49 установок по озонированию питьевой воды.
К 1977 г. во всем мире действует уже более 1000 установок. Широкое же распространение озон получил только в течение последних 30 лет, благодаря появлению надежных и компактных аппаратов для его синтеза — озонаторов (генераторов озона).
В настоящее время 95% питьевой воды в Европе проходит озонную подготовку. В США идет процесс перевода с хлорирования на озонирование. В России действуют несколько крупных станций (в Москве, Нижнем Новгороде и других городах).
2. Озон и его свойства
Механизм образования и молекулярная формула озона
Известно, что молекула кислорода состоит из 2-х атомов: O2 . При определенных условиях молекула кислорода может диссоциировать, т.е. распадаться на 2 отдельных атома. В природе эти условия создаются во время грозы при разрядах атмосферного электричества, и в верхних слоях атмосферы, под воздействием ультрафиолетового излучения солнца (озоновый слой Земли). Механизм образования и молекулярная формула озона. Однако, атом кислорода не может существовать отдельно и стремится сгруппироваться вновь. В ходе такой перегруппировки образуются 3-х атомные молекулы.
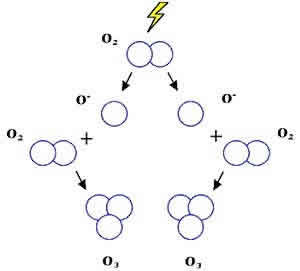
Молекула озона Молекула, состоящая из 3-х атомов кислорода, называется озон или активированный кислород, представляет собой аллотропную модификацию кислорода и имеет молекулярную формулу O3 (d = 1.28 A, q = 116.5°).
Следует отметить, что связь третьего атома в молекуле озона относительно непрочна, что обуславливает нестабильность молекулы в целом и ее склонность к самораспаду.

Свойства озона
 Озон O3 — голубоватый газ с характерным резким запахом, молекулярная масса 48 г/моль; плотность относительно воздуха 1,657 (озон тяжелее воздуха); плотность при 00С и давлении 0,1 МПа 2,143 кг/м3. Получение озона
Озон O3 — голубоватый газ с характерным резким запахом, молекулярная масса 48 г/моль; плотность относительно воздуха 1,657 (озон тяжелее воздуха); плотность при 00С и давлении 0,1 МПа 2,143 кг/м3. Получение озона
В малых концентрациях на уровне 0,01-0,02 мг/м3 (в пять раз ниже предельно допустимой для человека концентрации), озон придает воздуху характерный запах свежести и чистоты. Так, например, после грозы едва уловимый запах озона неизменно ассоциируется с чистым воздухом.
Как было сказано выше, молекула озона нестабильна и обладает свойством самораспада. Именно благодаря этому свойству озон является сильным окислителем и исключительным по эффективности дезинфицирующим средством.
Окислительный потенциал озона
Мерой эффективности окислителя служит его электрохимический (окислительный) потенциал, выраженный в вольтах. Ниже приведены значения электрохимического потенциала различных окислителей в сравнении с озоном:
| Окислитель | Потенциал, В | В % от потенциала озона | Использование окислителя в водоподготовке |
| Фтор (F2) | 2,87 | 139 | — |
| Озон (O3) | 2,07 | 100 | + |
| Перекись водорода (H2O2) | 1,78 | 86 | + |
| Перманганат калия (KMnO4) | 1,7 | 82 | + |
| Гипобромовая кислота (HOBr) | 1,59 | 77 | + |
| Гипохлоровая кислота (HOCl) | 1,49 | 72 | + |
| Хлор (Cl2) | 1,36 | 66 | + |
| Диоксид хлора (ClO2) | 1,27 | 61 | + |
| Кислород (O2) | 1,23 | 59 | + |
| Хромовая кислота (H2CrO2) | 1,21 | 58 | — |
| Бром (Br2) | 1,09 | 53 | + |
| Азотная кислота (HNO3) | 0,94 | 45 | — |
| Йод (I2) | 0,54 | 26 | — |
Из таблицы видно, что озон — самый сильный из всех окислителей, используемых в водоподготовке.
Применение на месте
Нестабильность озона обуславливает необходимость его применения непосредственно на месте получения. Озон не подлежит упаковке, хранению и транспортировке.
Растворимость озона в воде
В соответствии с законом Генри, концентрация озона в воде возрастает с увеличением концентрации озона в газовой фазе, подмешиваемой в воду. Кроме того, чем выше температура воды, тем ниже концентрация озона в воде.
Растворимость озона в воде выше, чем кислорода, но ниже, чем хлора, в 12 раз. Если рассматривать 100% озон, то его предельная концентрация в воде составляет 570 мг/л при температуре воды 20С. Концентрация озона в газе на выходе современных озонаторных установок достигает 14% по весу. Ниже приведена зависимость концентрации озона, растворенного в дистиллированной воде, от концентрации озона в газе и температуры воды.
| Концентрация озона в газовой смеси | Растворимость озона в воде, мг/л | |||
| 5°C | 10°C | 15°C | 20°C | |
| 1.5% | 11.09 | 9.75 | 8.40 | 6.43 |
| 2% | 14.79 | 13.00 | 11.19 | 8.57 |
| 3% | 22.18 | 19.50 | 16.79 | 12.86 |
Самораспад озона в воде и в воздухе
Скорость разложения озона в воздушной или водной среде оценивается при помощи периода полураспада, т.е. времени, в течение которого концентрация озона уменьшается вдвое.
Самораспад озона в воде (pH 7)
| Температура воды, °С | Период полураспада |
| 15 | 30 минут |
| 20 | 20 минут |
| 25 | 15 минут |
| 30 | 12 минут |
| 35 | 8 минут |
Самораспад озона в воздухе
| Температура воздуха, °C | Период полураспада |
| -50 | 3 месяца |
| -35 | 18 дней |
| -25 | 8 дней |
| 20 | 3 дня |
| 120 | 1.5 часа |
| 250 | 1.5 секунды |
Из таблиц видно, что водные растворы озона намного менее стабильны, чем газообразный озон. Данные по распаду озона в воде приведены для чистой воды, не содержащей растворенных и взвешенных примесей. Скорость распада озона в воде возрастает многократно в следующих случаях:
1. при наличии в воде примесей, окисляемых озоном (химическая потребность воды в озоне)
2. при повышенной мутности воды, т.к. на границе раздела между частицами и водой реакции самораспада озона протекают быстрее (катализ)
3. при воздействии на воду УФ облучением
3. Способы получения озона
В настоящее время широкое распространение получили 2 способа выработки озона:
* УФ-облучением
* под воздействием тихого (т.е. рассеянного, без образования искр) разряда коронного типа
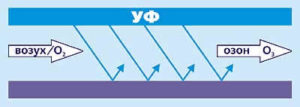
1. УФ-облучение
Озон может образовываться вблизи УФ ламп, однако только в маленьких концентрациях (0,1 вес.%).
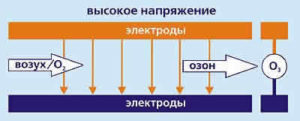
2.Коронный разряд
Тем же способом, которым озон образуется под действием электрических разрядов во время грозы, большое количество озона производится в современных электрических генераторах озона. Этот метод называется коронный разряд. Высокое напряжение пропускают через газовый поток, содержащий кислород. Энергия высокого напряжения разделяет молекулу кислорода О2 на 2 атома О, которые соединяются с молекулой О2 и образуют озон О3.
Чистый кислород, поступающий в генератор озона, можно заменить окружающим воздухом, содержащим большой процент кислорода.
Данный метод повышает содержание озона до 10-15 вес.%
Потребление энергии: 20 — 30 Вт/г О3 для воздуха 10 — 15 Вт/г О3 для кислорода
4. Применение озона для очистки и обеззараживания воды
Обеззараживание воды
Озон уничтожает все известные микроорганизмы: бактерии, вирусы, простейших, их споры, цисты и т.д.; при этом озон на 51% сильнее хлора и действует в 15-20 раз быстрее. Вирус полиомиелита погибает при концентрации озона 0,45 мг/л через 2 мин, а от хлора — только за 3 ч при 1мг/л.
На споровые формы бактерий озон действует в 300-600 раз сильнее хлора.
Озон разрушает окислительно-восстановительную систему бактерий и их протоплазму.
Биологические летальные коэффициенты (БЛК*) при использовании различных дезинфектантов
| Дезинфектант | Энтеробактерии | Вирусы | Споры | Цисты |
| Озон О3 | 500 | 5 | 2 | 0.5 |
| Гипохлористая кислота HOCl | 20 | 1 | 0.05 | 0.05 |
| Гипохлорит OCl- | 0.2 | <0.02 | <0.0005 | 0.0005 |
| Хлорамин NH2Cl | 0.1 | 0.0005 | 0.001 | 0.02 |
*Чем выше БЛК, тем мощнее дезинфектант
Сравнение дезинфектантов
| ОЗОН | УФ | ХЛОР | |
| E. coli | Да | Да | Да |
| Salmonella | Да | Да | Да |
| Giardia | Да | Да | Да |
| Legionnaire | Да | Нет | Нет |
| Crypto-sporidium | Да | Нет | Нет |
| Virus | Да | Нет | Нет |
| Микроводоросли | Да | Нет | Нет |
| Риск образованиея тригалометанов | Нет | Нет | Да |
Дезодорация воды
При озонировании окисляются органические и минеральные примеси, являющиеся источником запахов и привкусов. Вода, прошедшая обработку озоном, содержит больше кислорода и по вкусу напоминает свежую родниковую воду.
Финишная подготовка питьевой воды на линиях розлива
Озонирование на линии розлива. Очищенная и подготовленная к розливу вода, насыщается озоном, полностью дезинфицируется и на относительно короткое время сама  приобретает дезинфицирующие свойства. Благодаря этому повышается микробиологическая безопасность процесса розлива, озонированная вода надежно стерилизует стенки тары, пробку и воздушный зазор под пробкой. Срок хранения воды после озонирования увеличивается многократно. Особенно эффективна комбинированная обработка воды озоном в сочетании с ополаскиванием тары.
приобретает дезинфицирующие свойства. Благодаря этому повышается микробиологическая безопасность процесса розлива, озонированная вода надежно стерилизует стенки тары, пробку и воздушный зазор под пробкой. Срок хранения воды после озонирования увеличивается многократно. Особенно эффективна комбинированная обработка воды озоном в сочетании с ополаскиванием тары.
Окисление железа, марганца, сероводорода
Железо, марганец и сероводород легко окисляются озоном. Железо при этом переходит в нерастворимую гидроокись, которая затем легко задерживается в фильтрах. Марганец окисляется до перманганат-иона, который легко удаляется на угольных фильтрах. Сероводород, сульфиды и гидросульфиды переходят в безвредные сульфаты. Процесс окисления и формирования фильтруемых осадков при озонировании протекает в среднем в 250 раз быстрее, чем при аэрации. Особенно эффективно применение озона для обезжелезивания вод, содержащих железоорганические комплексы и бактериальные формы железа, марганца и сероводорода.
Очистка поверхностных вод от антропогенных примесей
Озонирование предварительно осветленной воды с последующей фильтрацией через активированный уголь — надежный способ очистки поверхностных вод от фенолов, нефтепродуктов, пестицидов и тяжелых металлов (окислительно-сорбционная очистка).
Очистка и обеззараживание воды на птицефабриках и фермах
 Озонирование на птицефабрике. Подача воды, обеззараженной озоном, в поилки для птицы и животных не только способствует снижению заболеваемости и риска массовых эпидемий, но и вызывает ускоренную прибавку в весе птиц и животных.
Озонирование на птицефабрике. Подача воды, обеззараженной озоном, в поилки для птицы и животных не только способствует снижению заболеваемости и риска массовых эпидемий, но и вызывает ускоренную прибавку в весе птиц и животных.
Очистка и обеззараживание стоков
При помощи озона сточные воды обесцвечиваются.
При помощи озонирования сточные воды могут быть приведены в соответствие жестким требованиям рыбохозяйственных водоемов по содержанию фенолов, нефтепродуктов и ПАВ, а также микробиологическим показателям.
Озонирование воды для санитарной обработки продуктов и оборудования
 Как было сказано выше, срок хранения воды, озонируемой в процессе розлива, увеличивается значительно за счет того, что продуктовая вода приобретает свойства дезинфицирующего раствора.
Как было сказано выше, срок хранения воды, озонируемой в процессе розлива, увеличивается значительно за счет того, что продуктовая вода приобретает свойства дезинфицирующего раствора.
При переработке пищевых продуктов, на загрязненном оборудовании размножаются бактерии, являющиеся источником сильных запахов гниения и разложения. Ополаскивание оборудования озонированной водой после удаления основной массы загрязнений приводит к дезинфекции поверхностей, освежающему воздействию на воздух помещения и улучшению общего санитарного-гигиенического состояния производства.
Озонирование для санитарной обработки. В воде для санитарной обработки оборудования, в отличие от озонирования воды перед розливом, создаются более высокие концентрации озона.
Аналогично озонированной водой могут быть обработаны рыба и морепродукты, тушки птицы и овощи перед упаковкой. Срок службы обработанных перед закладкой на хранение продуктов увеличивается, а их внешний вид после хранения мало отличается от свежих продуктов.
5. Аспекты безопасности при эксплуатации озонового оборудования
Газообразный озон токсичен и способен вызывать ожог верхних дыхательных путей и отравление (как и любой другой сильный окислитель).
Предельно-допустимая концентрация (ПДК) озона в воздухе рабочей зоны регламентируется ГОСТом 12.1.005 «Общие санитарно-гигиенические требования к воздуху рабочей зоны», согласно которому она составляет 0,1мг/м3.
Запах озона фиксируется человеком в концентрациях 0,01-0,02мг/м3, что в 5-10раз меньше ПДК, поэтому появление слабого запаха озона в помещении не является тревожным сигналом. Для обеспечения надежного контроля содержания озона в производственном помещении должны быть установлены газоанализаторы, позволяющие осуществлять мониторинг концентрации озона и в случае превышения ПДК принять своевременные меры по ее снижению до безопасного уровня.
Любая технологическая схема, содержащая озоновое оборудование, должна быть оснащена газоотделителем, с помощью которого избыточный (не растворившийся) озон поступает в каталитический деструктор, где разлагается до кислорода. Подобная система позволяет исключить поступление озона в воздух производственного помещения.
Т.к. озон является сильнейшим окислителем, все газовые магистрали должны быть выполнены из озоностойких материалов таких, как нержавеющая сталь и фторопласт.